Врожденный иммунитет - 2 (Фагоцитоз)

К числу важнейших защитных реакций организма, имеющих значение как в наследственном (врожденном), так и приобретенном (адаптивном) иммунитете, относятся воспаление и фагоцитоз (поглощение и переваривание). Представьте – вы поранились, например, о шипы роз или посадили себе занозу. Кожный барьер нарушен. Микробы устремились в рану, почувствовав, что им открыли входные ворота. В ране они начинают размножаться, вырабатывать повреждающие клетки факторы, токсические для организма вещества. Ответом на это вторжение становится местная реакция воспаления, которая призвана отграничить этот очаг, не позволить распространиться инфекции на весь организм, и, конечно, справиться с микробами как можно быстрее в месте их проникновения. Через поврежденные стенки капилляров сосудов из кровяного русла проникают клетки крови, умеющие это делать. Конечно, в инактивации микробов участвуют и лизоцим, и комплимент, и другие неспецифические факторы, о которых мы говорили в предыдущей статье.
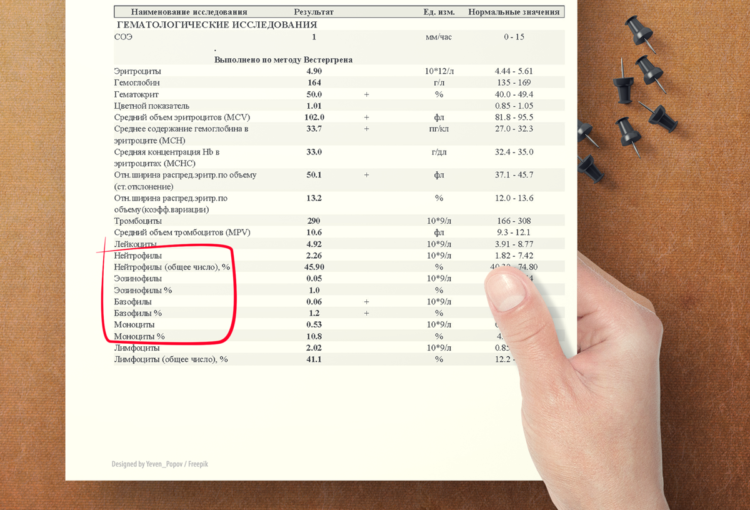
Но сейчас мы обсудим роль клеток крови, о существовании которых вы знаете, периодически сдавая общий анализ крови и, разглядывая его, пытаясь оценить результат еще до консультации с врачом. Именно лейкоциты образуют своеобразный воспалительный вал-границу, препятствующий выходу микробов непосредственно из очага в окружающее пространство. Именно их фагоцитарная активность оказывает решающее влияние на исход инфекции в месте проникновения микробов.
Заслуга открытия в 1882 году фагоцитоза и его последующего изучения принадлежит И.И.Мечникову. Его исследования о роли фагоцитоза на различных ступенях эволюции (от той самой одноклеточной амебы до высших животных) легли в основу фагоцитарной теории иммунитета, что в 1908 году было отмечено вручением Нобелевской премии.
В реакции фагоцитоза принимают участие клетки двух видов: микрофаги и макрофаги. Вспоминаем, как выглядит развернутый анализ крови – лейкоциты, которые делятся на виды (нейтрофилы, лимфоциты, эозинофилы, моноциты, базофилы). Про лимфоциты мы еще будем говорить в следующих статьях, посвященных иммунитету. А вот все остальные клетки – активные участники реакций фагоцитоза. К микрофагам относятся гранулоциты (базофилы, нейтрофилы, эозинофилы), которые первыми поступают в очаг воспаления. Часто в распечатках анализов крови с анализаторов можно увидеть именно общую цифру – количество гранулоцитов без расшифровки. Теперь вы знаете, что она означает.
К макрофагам относят моноциты, которые поступают из циркулирующей крови в инфицированные или поврежденные ткани и оседают там, а еще фиксированные макрофаги в печени, селезенке, лимфатических узлах и др.
Гранулоциты (от слова «гранула»), выходя из костного мозга, поступают в кровь, в процессе созревания обзаводятся гранулами – лизосомами, которые содержат более 25 видов ферментов (кислые гидролазы, миелопероксидазу и др.), бактерицидные белки, щелочную фосфатазу, лизоцим, лактоферрин. Эти клетки находятся в кровяном русле не более 6—7 часов, после чего они поступают в ткани, где и осуществляют свою миссию. Поэтому в анализах крови мы достаточно быстро видим повышение их количества при развитии инфекционного процесса, и так же быстро – понижение при выздоровлении. Это помогает врачам оценивать динамику течения болезни и эффективности терапии. Моноциты же циркулируют в кровяном русле гораздо дольше – до 3 дней, а затем, проникая в ткани, сохраняют свою жизнеспособность до нескольких месяцев.
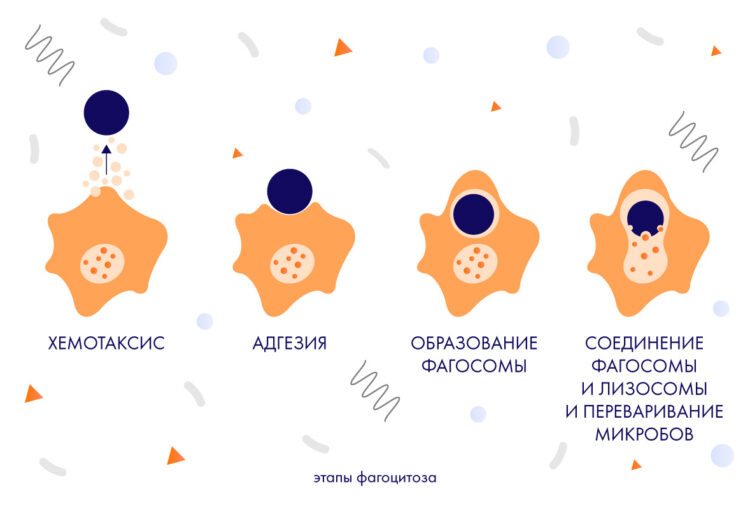
В реакции фагоцитоза различают несколько последовательных стадий:
1 – выход лейкоцитов из сосудов и скопление их вокруг проникшего в организм патогена (с помощью хемотаксиса– направленного движения клеток);
2 – прилипание (адгезия) фагоцита к чужеродному объекту;
3 – поглощение микробов фагоцитами, образование фагосомы;
4 – соединениефагосомы с лизосомой и переваривание фагоцитами поглощенных микробов
Сразу после проникновения патогена в очаге воспаления происходит активация фагоцитов, их переваривающей способности, как за счет кислороднезависимых, так и кислородзависимых (более эффективных) механизмов. При последнем образуются реактивные кислородсодержащие молекулы, которые обладают противомикробным действием. Соединения кислорода токсичны как для патогена, так и для самой клетки, поэтому они хранятся в ячейках внутри самой клетки. Такой метод уничтожения проникающих микроорганизмов называют кислородзависимое внутриклеточное уничтожение, а процесс называют «респираторным (кислородным) взрывом». К другому типу относят использование фагоцитами фермента миелопероксидазы из гранул. Когда гранулы сливаются с фагосомой, миелопероксидаза освобождается в фаголизосому, и этот фермент использует пероксид водорода и хлор для создания гипохлорита. Гипохлорит крайне токсичен для бактерий. (Кстати, Миелопероксидаза содержит пигмент гемм, за счет которого образуется зеленый цвет секретов, богатых нейтрофилами, т.е. гноя). В большинстве случаев таким образом удается локализовать «чужое», не пустить его дальше первичного очага и уничтожить на месте.
Однако не все микробы одинаково поддаются фагоцитозу. У некоторых бактерий есть способность тормозить первую фазу фагоцитоза, т. е. соприкосновение их с поверхностью фагоцита. Другие вообще могут в фагоцитах размножаться. А есть и такие, которые могут не только размножаться, но и оставаться там защищенными от антител или химиотерапевтических средств. Например, для того чтобы убить туберкулезную палочку внутри макрофагов, требуется в 50—100 раз больше стрептомицина, чем для инактивации свободных бактерий.
Фагоцитарную активность могут подавлять токсины, а также специальные ферменты, вырабатываемые микробами.
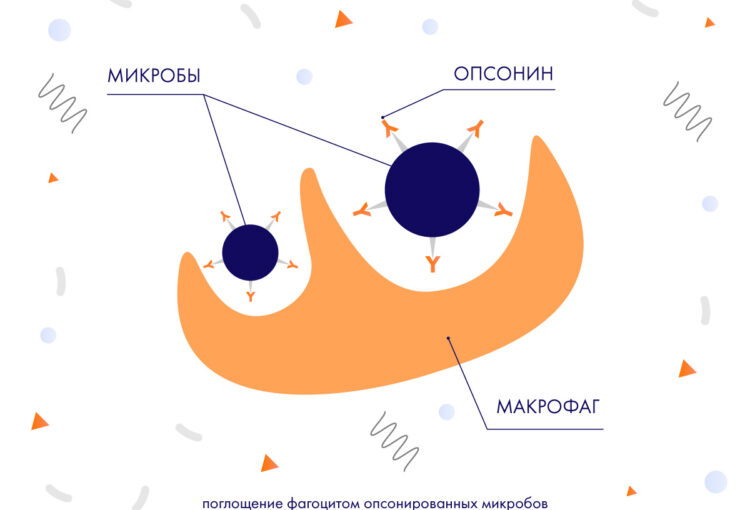
Но существуют и факторы, активизирующие фагоцитарный процесс. Один из них – опсонины, открытые в 1903 г., – вещества, вступающие в непосредственную связь с микробами, благодаря чему последние становятся более доступными фагоцитозу. Опсонинами могут быть и иммуноглобулины, С-реактивный белок, некоторые компоненты комплимента. Поэтому дефицит этих факторов косвенно приводит к ослаблению фагоцитоза и увеличению тяжести инфекций.
Фагоцитарная активность зависит, в том числе, от генетических свойств животного и от полноценности его питания. У животных, получающих достаточное количество белка, она была выше, чем у животных, находившихся на безбелковой или низкобелковой диете. Путем скрещивания в экспериментах удавалось получить потомство кроликов, как устойчивых, так и высокочувствительных к туберкулезу.
Устойчивость макрофагов к инфекции также меняется с возрастом. Инфицированные макрофаги от молодых животных могут быть переносчиками вируса, в отличие от макрофагов взрослых, которые переваривают их быстрее. Большие дозы глюкокортикоидов (противовоспалительных гормонов) уменьшают поступление в очаг фагоцитов, захват последними микробов и их переваривание. Под их действием взрослые мыши становятся так же восприимчивыми к вирусам Коксаки, как и новорожденные. Из-за этого эффекта применение глюкокортикоидов даже с лечебной целью может вести к обострению , например, туберкулеза. Установлено гормональное влияние щитовидной, поджелудочной и половых желез на защитные реакции организма в отношении некоторых инфекций.
Наш организм постоянно подвергается атаке множества условнопатогенных, реже –патогенных микроорганизмов. Но наш врожденный иммунитет справляется с ними, уничтожая агрессора в локальных микроочагах воспаления. Постоянный контакт с окружающей нас микрофлорой поддерживает нормальную активность иммунной системы, ее готовность к защите. Если же патогенных микроорганизмов много или их вирулентность(способность вызывать болезнь) велика и врожденный иммунитет с ними не справляется, то развиваются иммунные реакции, опосредованные факторами адаптивного иммунитета, о которых речь пойдет в наших следующих статьях.
